Hodnocení střevního postižení u pacientů s Crohnovou chorobou pomocí MaRIA skórovacího systému
Vlastimil Válek Orcid.org 1, Markéta Smělá1, Marek Dostál1,2, Štefan Konečný3, Daniel Bartušek Orcid.org 1, Lucie Prokopová Orcid.org 3
+ Pracoviště
Souhrn
Úvod: Zobrazovací metody mají v diagnostice pacientů s Crohnovou chorobou nezastupitelnou úlohu. V současné době existuje několik skórovacích systémů, jejichž cílem je pomocí předem stanovených parametrů objektivizovat hodnocení zánětlivého postižení střeva. Cílem této práce bylo srovnání nálezu zánětlivého střevního postižení na koloskopii a magnetické rezonanci (MR) při použití skórovacího systému MaRIA. Materiály a metody: Pacienti s Crohnovou chorobou podstoupili v rozmezí do 2 měsíců koloskopii a MR enterografii ve Fakultní nemocnici Brno v letech 2020–2022. Aktivita onemocnění na koloskopii byla hodnocena pomocí SES-CD a Rutgeerts score, na MR pomocí MaRIA skóre (zesílení stěny, její sycení, edém a přítomnost ulcerací). Nálezy z obou zobrazovacích metod byly srovnány, koloskopie byla zvolena zlatým standardem. U každého pacienta bylo analyzováno terminální ileum, tlusté střevo (rozdělené anatomicky na čtyři segmenty) a rektum. Výsledky: V této retrospektivní studii bylo analyzováno 203 střevních segmentů u 43 po sobě jdoucích pacientů (42 % mužů). Senzitivita MR enterografie v hodnocení aktivity střevního zánětu byla 62 %, specificita 94 %. Všechny parametry určující aktivitu zánětu na MR byly signifikantně vyšší u pacientů s aktivitou dle koloskopie a celková hodnota MaRIA skóre byla rovněž vyšší v této skupině (12,76 ± 7,48 vs. 5,27 ± 3,45; p < 0,001). Senzitivita se zvýšila na 90 % při izolované analýze tenkého střeva, při analýze tlustého střeva se naopak snížila na 34 %. Závěr: V naší studii jsme prokázali shodu mezi MR s použitím MaRIA skórovacího systému a koloskopií při hodnocení střevního zánětu u pacientů s Crohnovou chorobou.
Klíčová slova
Crohnova choroba, koloskopie, magnetická rezonance, MaRIA

Úvod
Crohnova choroba je chronické zánětlivé onemocnění trávicí trubice charakteristické přítomností opakujících se epizod akutních atak střídaných klidovými obdobími remise [1,2]. Pacienti jsou komplexně sledováni v pravidelných intervalech k vyloučení relapsu onemocnění, jeho pozdních komplikací a dalších přidružených onemocnění (primární sklerozující cholangitida, karcinom střev) [3–5]. U pacientů s akutní exacerbací obtíží je nutné vyloučení relapsu onemocnění včetně akutních komplikací (abscesů, píštělí) [6].
Magnetická rezonance (MR) je zobrazovací metoda, která se využívá k hodnocení přítomnosti a tíže zánětlivých změn na střevě [7,8]. Oproti koloskopii je její výhodou možnost hodnocení i okolí střeva včetně komplikací, jako jsou abscesy [9]. Navíc můžeme zobrazit postižení tenkého střeva, které není koloskopií dosažitelné [10]. Oproti výpočetní tomografii (CT) je její výhodou absence ionizujícího záření, což nám umožňuje provádět vyšetření opakovaně i u mladších pacientů [1]. Nevýhodou je menší dostupnost přístrojů a delší doba vyšetření.
Zlatým standardem v hodnocení zánětlivého postižení střevních kliček nadále zůstává koloskopie [10]. Tíže zánětlivých změn a jejich rozsah může být hodnocen pomocí skórovacích systémů. Často používaným je SES-CD (Simple Endoscopic Score for Crohn’s Disease) [11]. Za posledních 10 let byla publikována řada skórovacích systémů i pro MR s cílem objektivního posouzení tíže zánětu. Jedním z nejčastěji citovaných je MaRIA (Magnetic Resonance Index of Activity) [12].
Naším cílem bylo porovnání nálezů na koloskopii a MR (při použití skórovacího systému MaRIA) z hlediska hodnocení zánětlivého střevního postižení.
Materiály a metody
Výběr pacientů
V této retrospektivní studii byl analyzován soubor po sobě jdoucích pacientů s Crohnovou chorobou, u nichž byla s odstupem max. 2 měsíců provedena koloskopie a MR ve Fakultní nemocnici Brno od ledna 2020 do srpna 2022. Všichni pacienti byly starší 18 let a podstoupili koloskopii a vyšetření na MR v rozestupu < 2 měsíce.
MR protokol
Vyšetření na MR bylo provedeno na dvou přístrojích (Philips, 1,5T; Philips, 3T). V obou případech byl použit standardní vyšetřovací protokol zahrnující perorální podání 2 litrů 2,5% roztoku mannitolu a intravenózní aplikace 5 ml Buscopanu (před postkontrastními sekvencemi). Součástí protokolu bylo zhotovení T2 vážených obrazů v axiální a koronální rovině, koronálních T2 vážených obrazů s potlačením signálu tuku a koronálních T1 vážených obrazů. Po intravenózním podání gadoliniové kontrastní látky byly provedeny koronální T1 vážené scany v čase 30, 70, 180 s po podání kontrastní látky a axiální T1 v čase 300 s po aplikaci kontrastu (tab. 1, 2).
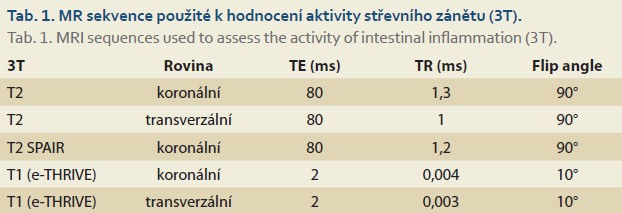
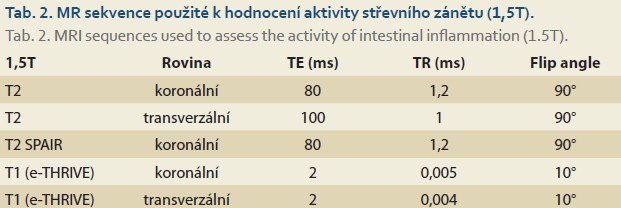
Hodnocení MR
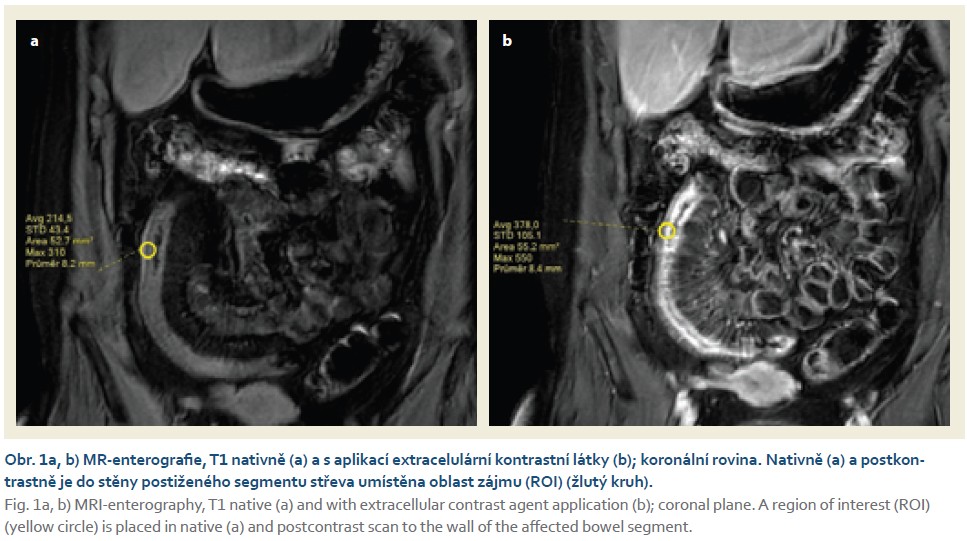
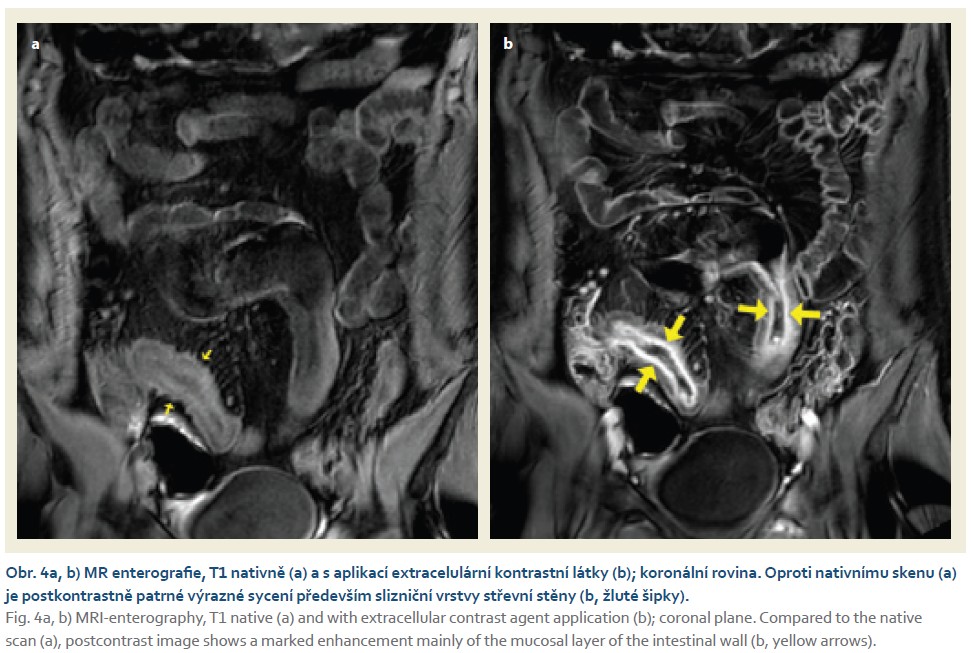
U každého pacienta bylo střevo rozděleno na šest segmentů (terminální ileum, colon ascendens, colon transversum, colon descendens, colon sigmoideum a rektum). Pro každý segment bylo spočítáno MaRIA skóre na základě stanoveného vzorce (tab. 3) [9]. Šíře stěny byla změřena na postkontrastních axiálních scanech, hodnocení edému stěny na T2 s potlačením signálu tuku a přítomnost ulcerací byla hodnocena na axiálních T2 scanech a na koronálních T2 s potlačením signálu tuku. Jako aktivní zánětlivé postižení jednotlivých segmentů byl hodnocen nález při hodnotě MaRIA > 7. V případě hodnoty > 11 byl nález hodnocen jako těžká aktivita. Sycení střevní stěny bylo vyhodnoceno pomocí nativního a postkontrastního vyšetření (v portovenózní fázi) v koronální rovině. Na obou scanech byla z každého segmentu vybrána klička, která byla jak nativně, tak postkontrastně v podobné lokalitě. Do stěny byla umístěna oblast zájmu (v každé fázi do podobného místa) a následně byla odečtena průměrná hodnota intenzity signálu na daných vyšetřeních (obr. 1a, b). Z hodnocení byly vyřazeny segmenty, které nebyly dostatečně distendované perorálním kontrastem a které nebyly přehledné během koloskopie. Vyhodnocení všech segmentů bylo provedeno jedním radiologem (VV), bez znalosti výsledků koloskopického vyšetření. Výsledky byly srovnány s koloskopií. Aktivita u pacientů byla hodnocena na základě aktivity jednotlivých segmentů, tzn. pacient měl aktivní střevní postižení, pokud byl postižen alespoň jeden ze střevních segmentů.

Koloskopie
Koloskopické vyšetření bylo provedeno po standardní přípravě zahrnující adekvátní vyprázdnění. Všechny analyzované segmenty byly makroskopicky prohlédnuty a na základě lokálního nálezu bylo stanoveno skóre postižení (SES-CD, event. Rutgeerts score u pacientů po resekci). Aktivní postižení bylo hodnoceno jako SES-CD > 2.
Statistické metody
Sumarizace kategoriálních proměnných byla provedena pomocí absolutních a relativních četností. Testování statistické významnosti rozdílu v základních charakteristikách mezi skupinami bylo vyhodnoceno pomocí Mannova-Whitneyho testu a Fisherova exaktního testu. Optimální cut-off hodnota MaRIA skóre byla definována pomocí Receiver Operating Characteristic analýzy (ROC) na základě maximálního součtu senzitivity a specificity. Jako hranice statistické významnosti byla určena hodnota p < 0,05.
Výsledky
Popis souboru
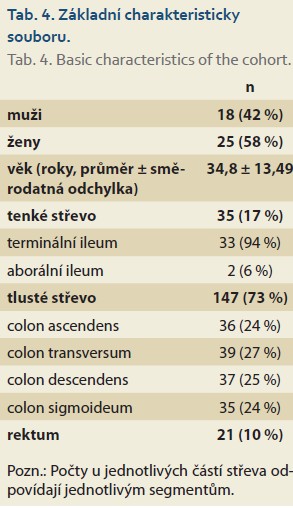
Do studie bylo zařazeno celkem 43 pacientů (42 % mužů; 37,2 ± 14 let), u nichž bylo analyzováno 203 střevních segmentů (po vyřazení 56 segmentů nehodnotitelných na MR a koloskopii). Celkem 17 % z nich (n = 35) bylo tenké střevo, 73 % (n = 147) tlusté střevo a 10 % (n = 21) rektum. U 77 % pacientů (n = 33) byl rozestup mezi koloskopií a MR < 1 měsíc, u zbylých 23 % (n = 10) byl rozestup 1–2 měsíce (tab. 4, 5).


Celkové srovnání koloskopie a MR
Aktivita byla dle endoskopie u 79 % pacientů (n = 34), z nichž 82 % (n = 28) mělo těžkou aktivitu s podílem ulcerací. Koloskopie celkově prokázala aktivitu u 30 % (n = 60) střevních segmentů: z toho v 77 % (n = 46) byla aktivita těžká, zbylých 70 % (n = 143) bylo bez aktivity. Dle MR enterografie s použitím MaRIA skórovacího systému bylo aktivní zánětlivé postižení u 23 % (n = 46) segmentů, 77 % (n = 157) bylo bez aktivity. Senzitivita MR enterografie byla 62 % (u 37 z 60 segmentů se zánětem na koloskopii byla aktivita i na MR), specificita 94 % (u 134 ze 143 segmentů bez zánětu na koloskopii nebyla na MR aktivita), pozitivní prediktivní hodnota 80 % a negativní prediktivní hodnota 85 %, při srovnání s koloskopií jako zlatým standardem (tab. 6). U pacientů s těžkou aktivitou (MaRIA > 11) dle MR enterografie byly na koloskopii častěji patrné ulcerace (33 vs. 12; p < 0,001) ve srovnání se zbytkem pacientů. MR však dokázala odhalit ulcerace jen v 7 případech (senzitivita 16 %, specificita 98 %; obr. 2). Celkem 56 % (n = 25) ulcerací bylo dle koloskopie v tenkém střevě, 42 % (n = 19) v tlustém a 2 % (n = 1) v rektu. Senzitivita MR stran hodnocení těžké aktivity na koloskopii byla 72 % a specificita 93 %. Optimální cut-off hodnota MaRIA skóre k odlišení segmentů s aktivitou dle koloskopie od segmentů bez aktivity byla 5,64 (AUC = 0,85 (95% CI 0,783–0,918)).
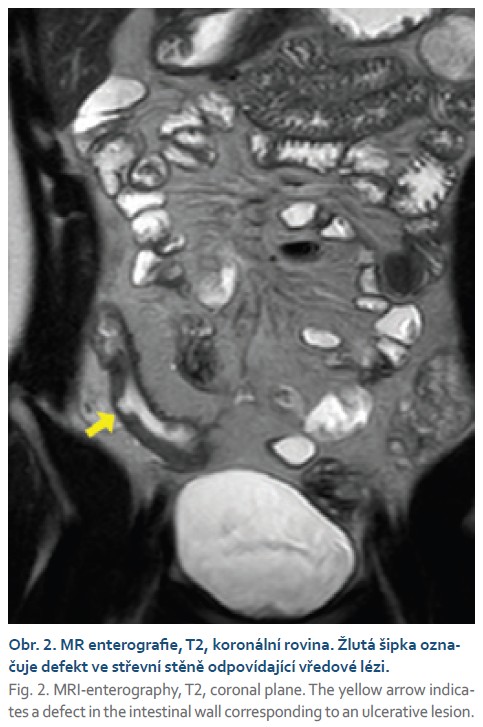

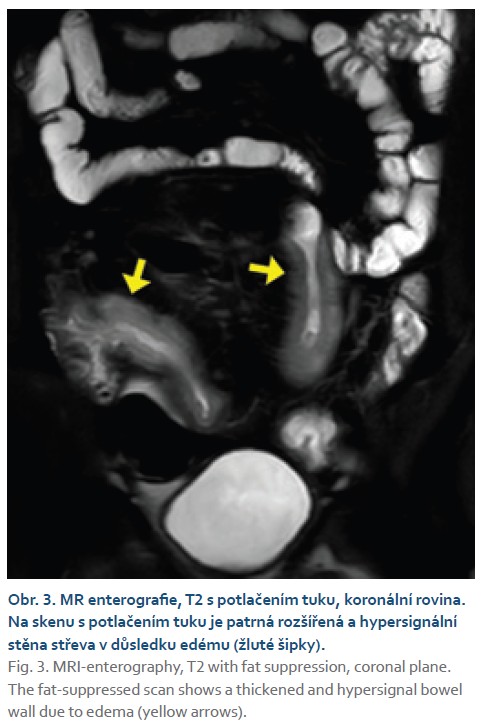
Průměrná šíře střevní stěny (4,75 ± ± 2,12 mm vs. 2,84 ± 0,95 mm; p < 0,001) a hodnota MaRIA skóre (12,76 ± 7,48 vs. 5,27 ± 3,45; p < 0,001) byla vyšší u pacientů s aktivitou dle koloskopie ve srovnání s pacienty bez aktivity na koloskopii. Edém střevní stěny dle MR se rovněž vyskytoval častěji u pacientů s aktivitou na koloskopii (35 vs. 8; p < 0,001) (obr. 3).
Stěna se sytila výrazně více u pacientů s aktivitou na koloskopii (69,24 ± ± 40,82 vs. 29,12 ± 35,63; p < 0,001) (obr. 4a, b; tab. 7).

Srovnání koloskopie a MR při hodnocení terminálního ilea
Senzitivita MR ve srovnání s koloskopií byla 90 %, specificita 67 %, pozitivní prediktivní hodnota 93 % a negativní prediktivní hodnota 57 %.
U pacientů s aktivitou na koloskopii se stěna sytila (RCE – relative contrast enhancement) nesignifikantně méně ve srovnání se skupinou bez koloskopického nálezu (87,36 ± 39,10 vs. 103,18 ± 97,17; p = 0,630). Průměrná hodnota MaRIA skóre byla nesignifikantně vyšší ve skupině s koloskopickým nálezem aktivního zánětlivého postižení ve srovnání se skupinou bez postižení (16,65 ± 6,67 vs. 12,02 ± 9,98; p = 0,149).
Srovnání koloskopie a MR při hodnocení tlustého střeva
Senzitivita MR ve srovnání s koloskopií byla 34 %, specificita 96 %, pozitivní prediktivní hodnota 67 % a negativní prediktivní hodnota 86 %.
U pacientů s aktivitou na koloskopii se stěna sytila (RCE) více ve srovnání se skupinou bez koloskopického nálezu (52,85 ± 36,29 vs. 25,95 ± 27,65; p < 0,001). Průměrná hodnota MaRIA skóre byla vyšší ve skupině s koloskopickým nálezem aktivního zánětlivého postižení ve srovnání se skupinou bez postižení (9,14 ± 6,52 vs. 4,77 ± 1,95; p < 0,001).
Srovnání koloskopie a MR při hodnocení rekta
Senzitivita MR ve srovnání s koloskopií byla 50 %, specificita 89 %, pozitivní prediktivní hodnota 33 % a negativní prediktivní hodnota 94 %.
U pacientů s aktivitou na koloskopii se stěna sytila (RCE) nesignifikantně více ve srovnání se skupinou bez koloskopického nálezu (44,2 ± 7,3 vs. 25,4 ± 22,6; p = 0,151). Průměrná hodnota MaRIA skóre byla nesignifikantně vyšší ve skupině s koloskopickým nálezem aktivního zánětlivého postižení ve srovnání se skupinou bez postižení (8,9 ± 4,5 vs. 6,2 ± 4,9; p = 0,93).
Diskuze
Endoskopické vyšetření zůstává v současné době metodou volby při hodnocení zánětlivých změn terminálního ilea a tlustého střeva u pacientů s Crohnovou chorobou [10]. S ohledem na nutnost častých a opakovaných kontrol je vhodnou alternativou neinvazivní MR [12]. Oproti koloskopii (kterou je vyšetřitelný jen krátký úsek terminálního ilea) umožňuje navíc hodnocení celého tenkého střeva a eventuálních komplikací zánětu [10].
U pacientů s aktivním zánětem střeva dochází k edematóznímu zbytnění střevní stěny, které se projeví jejím rozšířením [12]. Při edému se zvýší množství vody ve stěně, což lze hodnotit na T2 vážených obrazech s potlačením signálu tuku, kde tyto změny vykazují zvýšený signál [4]. Pacienti se zánětlivými změnami na koloskopii měli stěnu širší (p < 0,001) a ve větší míře byl u nich patrný edém (p < 0,001). Další známkou zánětu je hyperemie střevní stěny, která vede k jejímu výraznějšímu postkontrastnímu sycení [7]. V našem souboru se stěna sytila více u pacientů s aktivním zánětem dle koloskopie (p < 0,001). Při analýze jednotlivých částí střeva jsme prokázali signifikantní rozdíl jen u tlustého střeva. To může být dáno malým počtem analyzovaných segmentů tenkého střeva ve srovnání s colon (35 vs. 147).
V současné době existuje řada MR skórovacích systémů, jejichž snahou je objektivizovat zánětlivé postižení střeva. Nejčastěji používaným je MaRIA skóre hodnotící výše zmíněné parametry [12]. Při použití MaRIA skóre k hodnocení zánětlivých změn střeva na MR byla specificita (94 %) v našem souboru podobná jako u jiných autorů (89–97 %), zatímco senzitivita (62 %) byla ve srovnání s jinými studiemi menší (76–88 %) [10,13,14]. V našem souboru bylo celkem 23 segmentů s aktivitou dle koloskopie s negativním nálezem na MR. Ve 13 % se jednalo o tenké střevo, v 83 % o tlusté a ve 4 % o rektum.
Při samostatné analýze tenkého střeva (terminálního ilea) se zvýšil záchyt zánětlivých změn na MR (senzitivita 90 %). Výsledek je dokonce vyšší v porovnání s jinou studií, kde autoři analyzovali pouze pacienty s postižením terminálního ilea (76 %) [13]. Současně však polovina vyšetření byla falešně pozitivní. Crohnova choroba je charakteristická transmurálním postižením střeva. Zatímco pomocí endoskopických metod hodnotíme stav sliznice, pomocí MR můžeme hodnotit celou stěnu (transmurální zánět) vč. jejího okolí [15]. Tento fakt může být jedním z vysvětlení vysoké míry falešně pozitivních výsledků v našem souboru. Dalším faktorem může být celkově malý počet vyšetřených segmentů tenkého střeva (n = 35). Podmínkou hodnocení jednotlivých parametrů MaRIA skóre je adekvátní distenze střevních kliček perorálním kontrastem [1,16]. S ohledem na protokol podání perorálního kontrastu je optimální náplň především tenkého střeva. Směrem aborálně kvalita distenze klesá [17]. To může být jedním z důvodů nižší výtěžnosti MR při hodnocení zánětlivých změn v tlustém střevě.
MaRIA skóre rozlišuje dva stupně aktivity. Cut-off hodnota těžké aktivity je 11. Známkou těžké aktivity dle koloskopie je mimo jiné přítomnost ulcerací [10]. Ulcerace se častěji vyskytovaly na koloskopii u segmentů s těžkou aktivitou dle MR (p < 0,001). Na druhou stranu ulcerace na MR byly správně odhaleny jen v 16 % případů. Obrazu ulcerací na MR odpovídají pruhovité defekty směřující z lumen do střevní stěny, které jsou vyplněné kontrastní látkou [1]. Stěna střeva byla výrazně širší u segmentů s ulceracemi na koloskopii (5,08 ± 2,1 vs. 2,93 ± 1,11; p < 0,001). Při výrazně rozšířené a edematózní střevní stěně nemusí být distenze lumen optimální, což by mohlo být vysvětlením pro omezené hodnocení slizničních změn (ulcerací) [17].
Vyšetření MR umožňuje podrobné hodnocení tenkého střeva, které není klasickou koloskopií dosažitelné [10]. Až u 70 % pacientů se během 10 let trvání nemoci rozvine stenotické postižení střeva [18]. Hodnocení segmentů orálně od stenózy je pak limitované. MR může zhodnotit i stenotické segmenty terminálního ilea [1], navíc lze prohlédnout i orálně navazující kličky a posoudit přítomnost prestenotické dilatace [4]. Tlusté střevo často není optimálně distendované při použití standardního protokolu s perorální kontrastní látkou [19]. V takovém případě může být problematické hodnocení zánětlivých změn. Rizikem je například nadhodnocení sycení mukózy u kolabovaného segmentu colon [20]. Jednou z možností řešení tohoto problému je modifikace přípravy pacienta před vyšetřením pitím většího množství perorální kontrastní látky po delší dobu, tak aby se optimálně naplnilo i tlusté střevo.
Limitací naší práce je malý soubor pacientů v souboru, který je částečně vyvážen velkým počtem celkově analyzovaných segmentů střeva. Další limitací je nehomogenita souboru – z analyzovaných segmentů byla většina tlusté střevo, z tenkého střeva pak všechny segmenty tvořily terminální část ilea. Nehomogenita byla i stran rozložení aktivity – u většiny pacientů s aktivitou na koloskopii bylo patrné těžké postižení s ulceracemi. Souvisí to mimo jiné s tím, že tito pacienti jsou sledováni primárně na našem pracovišti. Kromě toho pacienti s lehčí aktivitou dle koloskopie či bez aktivity jsou sledováni pomocí MR v delším časovém odstupu (není splněn rozestup mezi MR a koloskopií < 2 měsíce), nebo jsou sledováni pomocí ultrasonografie. Dvouměsíční rozestup mezi vyšetřeními je další limitací. U léčených pacientů mohlo během této doby dojít ke změně lokálního nálezu. Protože v průběhu vyšetření dochází k pohybu a změně pozice střevních segmentů (i přes podání spazmolytických látek, např. Buscopanu), nemusely být oblasti zájmu umístěné na MR do střevní stěny v přesně stejném místě, což mohlo ovlivnit výsledky měření.
Závěr
Vyšetření MR je vhodnou alternativou k pravidelnému a opakovanému sledování pacientů s Crohnovou chorobou. Výhodou oproti koloskopii je především možnost hodnocení postižení tenkého střeva a lokálních komplikací zánětu. V některých případech je proto nutná korelace s dalšími metodami a klinickým a laboratorním vyšetřením. V naší studii jsme prokázali signifikantní shodu nálezu mezi MR a koloskopií při hodnocení zánětlivých změn střeva s využitím MaRIA skórovacího systému.
ORCID autorů
V. Válek 0000-0002-1593-0142,
M. Dostál 0000-0003-1740-9227,
Š. Konečný 0000-0002-7709-3079,
D. Bartušek 0000-0003-2761-2712,
L. Prokopová 0009-0008-9037-3738.
Doručeno/Submitted: 20. 7. 2024
Přijato/Accepted: 11. 11. 2024
Korespondenční autorka
MUDr. Markéta Smělá, Ph.D.
Klinika radiologie a nukleární medicíny
LF MU a FN Brno
Jihlavská 20
625 00 Brno
smela.marketa@fnbrno.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Lišková Z, Sláviková K, Mikula P et al. MR enterographic evaluation of the small bowel Crohn’s subtypes. Ces Radiol 2018; 72(3): 151–160.
2. Čan V, Mareš F, Kala Z et al. Ileocaecal Crohn’s disease and familial adenomatous polyposis in one patient – a case report. Gastroent Hepatol 2019; 73(1): 46–51. doi: 10.14735/amgh201946.
3. Hustý J, Bartušek D, Válek V et al. Využití kontrastního ultrazvuku v diagnostice aktivity Crohnovy nemoci. Ces Radiol 2013; 67(1): 39–45.
4. Guglielmo FF, Anupindi SA, Fletcher JG et al. Small bowel Crohn disease at CT and MR enterography: imaging atlas and glossary of terms. Radiographics 2020; 40(2): 354–375. doi: 10.1148/rg.2020190091.
5. Clarke WT, Feuerstein JD. Colorectal cancer surveillance in inflammatory bowel disease: practice guidelines and recent developments. World J Gastroenterol 2019; 25(30): 4148–4157. doi: 10.3748/wjg.v25.i30.4148.
6. Ge X, Hu D, Cao Y et al. Procalcitonin in Crohn’s disease with fever episodes, a variable to differentiate intra-abdominal abscess from disease flares. Int J Surg 2016; 36: 34–39. doi: 10.1016/j.ijsu.2016.10.011.
7. Mírka H, Ferda J, Ohlídalová K et al. Hodnocení dynamiky perfuze střevní stěny při stanovení aktivity Crohnovy choroby: porovnání ultrasonografie a magnetické rezonance s blood-pool kontrastní látkou. Ces Radiol 2009; 63(1): 42–47.
8. Marek F, Hrivnák R, Rovný I et al. Managing IBD therapy during pregnancy demands a multidisciplinary approach. Gastroent Hepatol 2021; 75(2): 149–158. doi: 10.48095/ccgh2021149.
9. Greer MLC, Cytter-Kuint R, Pratt L et al. Clinical-stage approaches for imaging chronic inflammation and fibrosis in Crohn’s disease. Inflamm Bowel Dis 2020; 26(10): 1509–1523. doi: 10.1093/ibd/izaa218.
10. Rimola J, Alvarez-Cofiño A, Pérez-Jeldres T et al. Comparison of three magnetic resonance enterography indices for grading activity in Crohn’s disease. J Gastroenterol 2017; 52(5): 585–593. doi: 10.1007/s00535-016-1253-6.
11. Xu W, Hua Z, Wang Y et al. The endoscopic prediction model of simple endoscopic score for Crohn’s disease (SES-CD) as an effective predictor of intestinal obstruction in Crohn’s disease: a multicenter long-term follow-up study. Front Surg 2022; 9: 984029. doi: 10.3389/fsurg.2022.984029.
12. Rimola J, Torres J, Kumar S et al. Recent advances in clinical practice: advances in cross-sectional imaging in inflammatory bowel disease. Gut 2022; 71(12): 2587–2597. doi: 10.1136/gutjnl-2021-326562.
13. Kakkar C, Singh A, Mahajan R et al. Correlation between magnetic resonance enterography and ileo-colonoscopy for assessment of disease activity in terminal ileal Crohn’s disease. Indian J Gastroenterol 2022; 41(5): 465–474. doi: 10.1007/s12664-022-01242-7.
14. Rimola J, Rodriguez S, García-Bosch O et al. Magnetic resonance for assessment of disease activity and severity in ileocolonic Crohn’s disease. Gut 2009; 58(8): 1113–1120. doi: 10.1136/gut.2008.167957.
15. Varyani F, Samuel S. Can Magnetic Resonance Enterography (MRE) replace ileo-colonoscopy for evaluating disease activity in Crohn’s disease? Best Pract Res Clin Gastroenterol 2019; 38–39: 101621. doi.org/10.1016/j.bpg.2019.05.008.
16. Kucharzik T, Tielbeek J, Carter D et al. ECCO-ESGAR topical review on optimizing reporting for cross-sectional imaging in inflammatory bowel disease. J Crohns Colitis 2022; 16(4): 523–543. doi: 10.1093/ecco-jcc/jjab180.
17. Jairath V, Ordas I, Zou G et al. Reliability of measuring ileo-colonic disease activity in Crohn’s disease by magnetic resonance enterography. Inflamm Bowel Dis 2018; 24(2): 440–449. doi: 10.1093/ibd/izx040.
18. Lin X, Wang Y, Liu Z et al. Intestinal strictures in Crohn’s disease: a 2021 update. Therap Adv Gastroenterol 2022; 15: 17562848221104951. doi: 10.1177/17562848221104951.
19. Campari A, Napolitano M, Zuin G et al. Colonic inflammation in pediatric inflammatory bowel disease: detection with magnetic resonance enterography. Pediatr Radiol 2017; 47(7): 850–859. doi: 10.1007/s00247-017-3833-x.
20. Rimola J, Ordás I. MR colonography in inflammatory bowel disease. Magn Reson Imaging Clin N Am 2014; 22(1): 23–33. doi: 10.1016/ j.mric.2013.07.011.





